Chờ kết luận thẩm định giai đoạn 3a vắc xin Nanocovax
23/08/2021 - 13:53
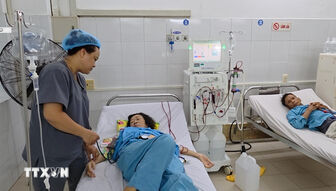
Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia (Bộ Y tế) đã họp vào ngày 22-8 để thẩm định kết quả thử nghiệm giữa kỳ giai đoạn 3a vắc xin Covid-19 Nanocovax.
-

Chuối rất tốt nhưng nên ăn bao nhiêu quả mỗi ngày?
Cách đây 8 phút -

Tận hưởng tiết xuân mát dịu qua những chiếc váy hoa tươi sáng
Cách đây 11 phút -

Phiếu bầu cử và cách bỏ phiếu đúng quy định
Cách đây 18 phút -

Bóng đá Việt Nam sắp nhận tin vui lớn
Cách đây 22 phút -

Bùng phát đụng độ tại khu vực biên giới Afghanistan - Pakistan
Cách đây 28 phút -

Israel lần đầu trưng bày cuốn Kinh Thánh cổ 2.100 tuổi
Cách đây 28 phút -

Việt Nam lọt top 5 thị trường xuất khẩu triển vọng của Pháp
Cách đây 29 phút -

Chương trình hòa nhạc "New Year Concert 2026" chào Xuân Bính Ngọ
Cách đây 29 phút -

Inter Milan bị loại khỏi Champions League
Cách đây 29 phút -

Thời tiết 25/2: Bắc Bộ trời lạnh, mưa dông diện rộng
Cách đây 1 giờ -

Lên Y Tý săn mây ở độ cao 2.000 mét
Cách đây 1 giờ -

Tỷ giá USD hôm nay (25/2): Đồng USD tăng nhẹ
Cách đây 1 giờ -

Đổi mới toàn diện vì người bệnh
Cách đây 1 giờ -

Xuân phên giậu - Bài 2: Hòa quyện tình quân - dân
Cách đây 1 giờ -

Ngắm “phố núi” trên cao
Cách đây 1 giờ -

AI hỗ trợ học sinh khiếm thị
Cách đây 1 giờ





























![[Infographic] Phòng chống đái tháo đường cho người bình thường, khỏe mạnh như thế nào [Infographic] Phòng chống đái tháo đường cho người bình thường, khỏe mạnh như thế nào](https://images.baoangiang.com.vn/image/news/2026/20260222/thumbnail/510x286/-infographic-phong-_8554_1771724277.webp)
 Đọc nhiều
Đọc nhiều










![[Infographic] Phòng chống đái tháo đường cho người bình thường, khỏe mạnh như thế nào [Infographic] Phòng chống đái tháo đường cho người bình thường, khỏe mạnh như thế nào](https://images.baoangiang.com.vn/image/news/2026/20260222/thumbnail/336x224/-infographic-phong-_8554_1771724277.webp)



